新闻网讯 药学院叶英副教授在真菌生物碱类杀虫抗生素brevianamides的生物合成机制研究方面取得突破,5月18日,相关研究成果以“Fungal-derived brevianamide assembly by a stereoselective semipinacolase”为题,在线发表于国际催化领域Top期刊《自然·催化》(Nature Catalysis),叶英副教授为论文第一作者。
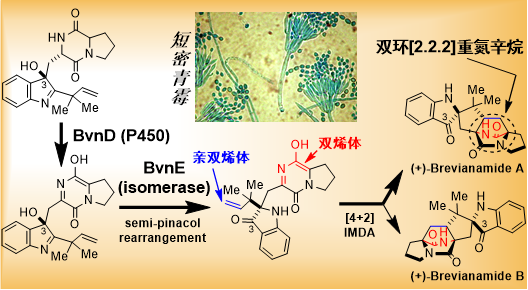
近半个世纪以来,含有双环[2.2.2]重氮辛烷结构单元的真菌吲哚类生物碱因其多样的生物活性、独特的化学结构以及神秘的生物合成机制受到微生物学、生物化学、天然药物化学及有机合成化学领域的广泛关注。尽管许多研究者对该类天然产物的新结构挖掘、生物活性和生物合成进行了大量研究,也陆续报道了一些代表性化合物如杀虫剂brevianamides、兽药paraherquamides、抗肿瘤活性物质notoamides等的仿生全合成,但这些真菌天然产物的生物合成机理,尤其是微生物如何组装产生非对映异构体(diastereomers)和对映异构体(enantiomers)衍生物的分子机制,已然成为天然产物生物合成领域的“圣杯”。
由短密青霉(Penicillium brevicompactum)产生的杀虫抗生素brevianamides是该类真菌生物碱的最早成员和典型代表,其结构中含有双环[2.2.2]重氮辛烷结构和少见的3位螺环吲哚骨架。半个世纪前,美国知名学者Sammes等首次提出双环[2.2.2]重氮辛烷基团可能通过[4+2] Diels-Alder环合反应(DA反应)产生的生源假说,但是该假说长期以来缺少直接的生物化学证据,成为生物合成领域的著名“悬案”。
该篇论文通过交叉运用微生物遗传学、功能基因组学、生物化学、合成化学、结构生物学与量子化学计算等多种手段,在国际上首次从短密青霉中揭示了brevianamide A的立体选择性合成机制,成功解决了这一“悬案”:发现由细胞色素P450单加氧酶BvnD催化二酮哌嗪环内C-N键的去饱和反应以提供DA反应必需的双烯体(diene),异构酶BvnE催化“频哪醇重排”(pinacol rearrangement)选择性产生DA反应前体,并导致3位螺环吲哚骨架的非对映选择性合成,最终通过自发的分子内DA反应(IMDA)生成brevianamide A与B。
上述研究结果不仅丰富了真菌生物合成酶催化复杂手性成环反应的机制性认识,而且将为未来运用组合生物合成与合成生物技术创造更多的活性吲哚类生物碱结构衍生物奠定理论基础,对于新型生物农药、兽药或人药的开发均具有十分重要的社会经济意义。
山东大学微生物技术国家重点实验室李盛英教授、美国密西根大学David Sherman教授和科罗拉多州立大学Robert Williams为本文共同通讯作者,李盛英教授课题组成员杜磊为共同第一作者。
叶英副教授博士毕业于日本北海道大学,师从真菌天然产物生物合成领域知名专家及川英秋教授,后在美国密歇根大学天然产物领域著名专家David Sherman教授实验室从事博士后研究,主要从事微生物/真菌天然药物化学及生物合成。2019年通过华中科技大学海外招聘专场被引进回国,目前在药学院天然药物化学与资源评价湖北省重点实验室工作。
本消息改编自李盛英教授通讯稿,原文链接:
https://mp.weixin.qq.com/s/xI68ibozVJ3PnirJNuYMWw
论文链接:
https://www.nature.com/articles/s41929-020-0454-9