新闻网讯 3月13日,协和医院代谢性心血管疾病研究团队在《自然·通讯》(Nature Communications)上发表了“Poly(ADP-ribose) polymerase 1 accelerates vascular calcification by upregulating Runx2”论文。这是继2月28日发表“Circulating myocardial microRNAs from infarcted hearts are carried in exosomes and mobilise bone marrow progenitor cells”一文后,该研究团队在《自然·通讯》上发表的第二项研究成果。
慢性肾病患者钙磷代谢紊乱,导致血管出现钙磷沉积(钙化),表现为管壁变硬、管腔变窄、血压升高,加剧组织器官缺血,显著增加患者心血管事件的发生率和死亡率。在“Poly(ADP-ribose) polymerase 1 accelerates vascular calcification by upregulating Runx2”一文中,该团队成员博士生王成和许文静发现血管平滑肌细胞内1型多聚ADP核糖合成酶(PARP1)的异常激活是慢性肾病所致血管钙化的重要原因:活化的PARP1导致平滑肌细胞失去正常的收缩功能,转化为成骨/软骨样细胞,胞内钙磷大量沉积并分泌钙化基质及蛋白,促使血管发生钙化。进一步研究揭示:PARP1通过促进炎症因子IL-6表达,激活JAK2/STAT3通路降低微小RNA(microRNA)miR-204表达,从而消除后者对转录因子Runx2的抑制作用,增加骨化相关蛋白(Col1A1, OPN,OCN)的表达,促使钙化发生。据协和医院代谢性心血管病团队负责人、该论文通讯作者黄恺教授介绍,此研究揭示了PARP1在慢性肾病患者血管钙化过程中的关键作用,阐明钙化并不是血管壁内钙磷的被动沉积,而是一个积极主动、可受调控的生物学过程,从而为解决肾病患者血管钙化的发生、发展和恶化提供一个全新的思路和治疗靶点。

图一 PARP1调控血管钙化
《自然·通讯》2月28日发表的“Circulating myocardial microRNAs from infarcted hearts are carried in exosomes and mobilise bone marrow progenitor cells”研究,是由该团队承担、团队PI程敏副教授为第一作者,我校特聘教授、团队主要合作者美国阿拉巴马大学(伯明翰分校)覃刚健教授为通讯作者的合作成果。该研究发现,心肌梗死患者外周血中外泌体携带的心肌特异性microRNA(myo-miR:miR-1a,miR-208a,miR-133a和miR-499-5p)显著升高,可达正常的1万至10万倍。动物实验证实,这些由外泌体携带的microRNA进入骨髓后,通过抑制骨髓单个核细胞CXCR4基因表达,促进骨髓祖细胞释入血液,修复损伤的心肌。程敏教授表示,本研究揭示外周血myo-miR不仅是生物标志物,更是介导缺血心脏和骨髓间信号传递的重要分子。鉴于骨髓祖细胞在心肌修复中的重要作用,这个新的器官间信号通路的发现有望为心脏缺血的治疗提供新靶点。据黄恺教授介绍,缺血性心脏病的死亡率高,一直是心血管领域研究的重点和热点。此项研究成果将为心肌梗塞等致命性心脏病的治疗、尤其是干细胞介导的心肌损伤修复治疗,提供重要的实验依据。
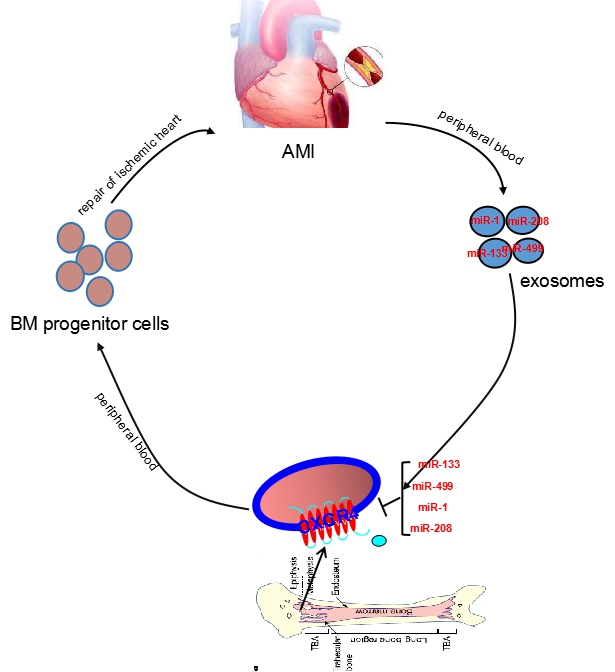
图二 外泌体介导的Myo-miR促骨髓祖细胞修复缺血心脏
上述两项研究得到国家重大基础研究计划和国家自然科学基金重点项目等的资助。